Fermentação
•Fermentação – processo anaeróbio em que ocorre a produção de ATP, a partir de compostos orgânicos, numa série de reacções redox, que não envolvem uma cadeia transportadora de electrões. A fermentação envolve menores ganhos energéticos já que apenas se formam 2 moléculas de ATP por molécula de glicose, enquanto que na respiraçãoaeróbia se formam 36 ATP.
Actividade Enzimática
•Metabolismo Celular – conjunto de reacções químicas que ocorrem numa célula. É através do metabolismo que é feita a gestão de recursos materiais e energéticos da célula. O metabolismo celular inclui reacções de:
•Catabolismo – moléculas complexas são convertidas em moléculas mais simples, com libertação de energia.
•Anabolismo – síntese de moléculas complexas a partir de moléculas simples, com gasto de energia.
As reacções de catabolismo e anabolismo relacionam-se de tal forma que a energia libertada pelas primeiras é utilizada nas segundas.
•Para que ocorra uma reacção química, tem de se verificar a ruptura de ligações químicas nas moléculas dos reagentes e a formação de novas ligações químicas que dão origem aos produtos de reacção. A energia necessária para uma reacção química se iniciar é a energia de activação (Ea).
A absorção de energia torna as moléculas dos reagentes instáveis, aumenta a sua energia cinética e a probabilidade de colidirem e aumenta a agitação dos átomos, enfraquecendo as ligações entre eles; atinge-se um estado de transição a partir do qual a reacção química é iniciada.
•Nas células, ocorrem reacções químicas que envolvem moléculas muito estáveis e cuja Ea é elevada. No entanto, não pode ser o calor a fornecer a Ea, uma vez que causaria a desnaturação das proteínas e a morte celular, e as reacções têm de ser rápidas.
•Uma reacção não catalisada depende do choque aleatório entre os reagentes. Como uma enzima possui uma estrutura muito específica pode ligar-se ao substrato e diminuir a aleatoriedade.
•As células possuem catalizadores – agentes químicos capazes de acelerar as reacções químicas sem serem consumidos durante esse processo.
Estrutura e propriedades das enzimas
- As enzimas são catalizadores biológicos que apresentam as seguintes características:
•aumentam a velocidade das reacções químicas, pois diminuem a energia de activação necessária para que as reacções se iniciem;
•não são consumidas nas reacções químicas que catalizam;
•são moléculas proteícas, com conformação tridimensional. Algumas necessitam de elementos não proteícos para a sua acção catalítica;
•são específicas, devido à sua natureza proteíca.
•Na ausência de enzimas, as reacções ocorreriam, mas com velocidades inferiores, o que não suportaria as propriedades da vida como a conhecemos.
•Natureza química das enzimas:
- porção proteíca maioritária (propriedades idênticas às proteínas) – pode ser total ou então constituir a apoenzima.
•Cofactores:
- iões metálicos (metaloenzima)
- moléculas orgânicas (coenzima)
- apoenzima + coenzima = holoenzima
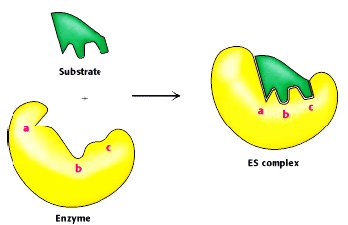
•A molécula sobre a qual a enzima actua é o substrato.
•As enzimas são proteínas com uma conformação tridimensional e possuem uma região através da qual se estabelece a ligação ao substrato – centro activo.
•A ligação do substrato ao centro activo da enzima forma o complexo enzima-substrato. As ligações que se estabelecem no complexo são fracas, mas suficientes para desencadear a conversão do substrato em produtos. Os produtos deixam o centro activo e a enzima fica livre para catalizar a transformação de outro substrato.
•Centro activo:
- É uma pequena porção da enzima;
- Tem estrutura tridimensional. A alteração da estrutura própria do local activo produz inactivação enzimática, em consequência da desnaturação proteíca;
- Os substratos ligam-se ao local activo por ligações químicas.
- Os locais activos são fendas ou frestas, onde se cria um microambiente próprio para o mecanismo de catálise.
- São altamente específicos. O substrato deve ter uma estrutura complementar para se ajustar ao local activo.
Muitas enzimas provocam a quebra de ligações nos substratos, enquanto outras promovem a formação de ligações, pois conseguem aproximar correctamente os substratos de modo a que estes reajam e formem uma ligação.
•Numa reacção química catalisada por uma enzima, e como resultado da sua actividade, verifica-se ao longo do tempo:
- a diminuição da concentração do substrato;
- a diminuição, seguida de estabilização, da concentração de enzima livre;
- o aumento, seguido de estabilização, do complexo enzima-substrato;
- o aumento da concentração de produto.
•A estabilização das concentrações de enzima livre e de complexo enzima-substrato reside no facto da velocidade de formação do complexo enzima-substrato igualar a velocidade de dissociação.
•A complementaridade entre o substrato e o centro activo da enzima está na origem da especificidade de acção enzimática. É possível distinguir:
- Especificidade absoluta – A enzima actua apenas sobre um determinado substrato;
- Especificidade relativa – A enzima actua sobre um conjunto de substratos quimica e estruturalmente relacionados.
•A especificidade absoluta pode ser interpretada pelo modelo chave-fechadura, proposto por Fisher no final do século XIX, e que considera o centro activo da enzima uma estrutura rígida e pré-complementar do substrato.
•Em 1959, Koshland propôs o modelo de encaixe induzido, que considera que o centro activo da enzima interage, de uma forma dinâmica, com o substrato, ajustando-se a ele quando se estabelece a ligação. Este novo modelo permitiu explicar a especificidade relativa de algumas enzimas.
Inibição Enzimática
•Inibidor – composto que se liga à enzima e que afecta negativamente a sua actividade. Pode ser:
•natural – utilizado pelas células para regularem o seu metabolismo.
•artificial – usado para combater doenças, eliminar pestes, estudar laboratorialmente as enzimas, indústria alimentar...
Tipos de inibição enzimática:
•Inibição irreversível – o inibidor combina-se permanentemente com a enzima, através de ligações covalentes, tornando-a inactiva ou provocando a sua destruição. Muitos venenos são inibidores enzimáticos irreversíveis, como é o caso do DDT, que inibe enzimas do sistema nervoso.
•Inibição reversível – o inibidor combina-se temporariamente com a enzima, através de ligações fracas, e, quando se dissocia, a enzima permanece funcional e capaz de transformar o substrato. A inibição pode ser:
•Inibição competitiva – o inibidor é uma molécula estruturalmente semelhante ao substrato, mas resistente à acção da enzima, e que compete com o substrato pelo centro activo da enzima. O efeito da inibição sobre a velocidade da reacção depende da concentração relativa de substrato e de inibidor. Aumentando a concentração de substrato, aumenta também a probabilidade de se estabelecerem ligações entre o substrato e a enzima em vez de se estabelecerem ligações entre o inibidor e a enzima.
•Inibição não competitiva ou alostérica – o inibidor é uma molécula estruturalmente diferente do substrato e liga-se à enzima num local que não é o centro activo e se designa centro alostérico. A ligação do inibidor ao centro alostérico provoca a alteração da conformação do centro activo, de tal modo que impede a ligação do substrato. A inibição não competitiva é utilizada na regulação das vias metabólicas.
•Indução – aumento da actividade da enzima por ligação com compostos indutores que promovem mudanças no centro activo da enzima que facilitam a ligação deste com o substrato